מחלות אוטואימוניות: נמצא המנעול לשער מערכת החיסון שימנע את ההתקפה עליה

ריאיון עם פרופ' אריה לב גרוזמן ממרכז דנגור לרפואה מותאמת אישית והמחלקה לכימיה באוניברסיטת בר-אילן, שפיתח חומר שעשוי לטפל ב-300 מחלות אוטואימוניות ללא תופעות לוואי
תרופה אחת ויחידה יכולה לטפל במחלות מוכרות רבות שבהן הגוף תוקף את עצמו - כמו טרשת נפוצה, קרוהן, דלקת מפרקים, סוכרת נעורים ועוד קרוב ל-300 מחלות אוטואימוניות אחרות - וללא שום תופעות לוואי!, כך קובע פרופ' אריה לב גרוזמן ממרכז דנגור לרפואה מותאמת אישית ומאוניברסיטת בר-אילן. הוא ושותפיו למחקר הצליחו להוכיח את קיומה של מולקולה שעושה בדיוק את זה: היא סוגרת "שער" יחיד במערכת החיסון שנפתח אך ורק בהתקפה אוטואימונית, תוך שהיא משאירה את כל שאר הגנות הגוף פעילות נגד סרטן, וירוסים וחיידקים. תוצאת המחקר מדהימה, הבעיה היא שהמימון לפיתוחה הופסק בגלל המלחמה, וכעת חסרים 12 מיליון דולרים כדי להביא אותה לחולים.
מחלות אוטואימוניות פוגעות בכל האוכלוסיות, בכל גיל. יש מאות מחלות כאלו - חלקן מאוד נפוצות וידועות, וביניהן סוכרת נעורים וכבד שומני. "כשאנחנו אומרים אוטואימוני, אנחנו בעצם לא יודעים מה קורה למערכת החיסון שלנו, יש לה איזשהו באג, איזושהי טעות, והיא מחליטה שמשהו בגוף שלנו הוא דבר זר שצריך להרוס ולהרוג אותו". בסוכרת נעורים, מערכת החיסון תוקפת את תאי הבטא שמייצרים אינסולין; בטרשת נפוצה, היא תוקפת את הציפוי של העצבים, "ואנחנו לא יכולים לתקן את זה, אי אפשר להחזיר את הגלגל אחורה, אז מטפלים בסימפטומים". כיום ישנן תרופות יעילות נגד מחלות אוטואימוניות - תרופות ביולוגיות והורמונים סטרואידים - אבל הן כרוכות בבעיות גדולות. "תופעות הלוואי בסטרואידים הן פשוט נוראיות", אומר פרופ' גרוזמן. כאן נכנס לתמונה החומר החדשני שפיתח.
"אדם מגיע לחדר מיון עם התקף של קרוהן, דימום במעיים או התקף של דלקת במפרקים", מתאר לנו פרופ' גרוזמן את העתיד האפשרי, "מזריקים לו את התרופה שלנו, ואחרי ארבעה ימים כל התסמינים נעלמים והוא יכול לתפקד בצורה רגילה, כי בעצם עצרנו את הגעת התאים הלבנים מהדם לרקמות החולות ואין מחלה אקוטית".
 מחלות אוטואימוניות פוגעות בכל האוכלוסיות, בכל גיל. יש מאות מחלות כאלו. קרדיט צילום: shutterstock
מחלות אוטואימוניות פוגעות בכל האוכלוסיות, בכל גיל. יש מאות מחלות כאלו. קרדיט צילום: shutterstock
גם למי שלא סובל מהתקף מיידי החומר יכול לעזור מאוד. "אם אדם עם כבד שומני בשלב מאוד מתקדם יקבל את החומר, התקדמות המחלה תואט. בגלל שלכבד יש יכולת לגדול מחדש בצורה מאוד מהירה, אם נציל אותו מהרג התאים, הם יודעים להתרבות ולהשלים את החוסר והכבד יבריא". אבל לא כל המחלות ניתנות לריפוי מלא. "במוח למשל, ברגע שאיבדנו את הנוירונים, הם לא יודעים להתרבות. ואין מה לעשות".
חוסמים את המסלול
"התחלנו את הפרויקט הזה מהתופעה הבסיסית שיש לכל מחלה אוטואימונית", מספר פרופ' גרוזמן על המחקרים שפורסמו בשנים 2019 ו-2021 על אודות מולקולהGT-73 . "תאים חיסוניים, תאים לבנים, עוזבים את הדם ומגיעים לאתר הפעולה. למשל, בסוכרת מסוג 1, הם מגיעים ללבלב, מגיעים לתאי הבטא והורגים אותם". אבל כדי שהתאים הלבנים יעזבו את הדם ויגיעו ללבלב, הם צריכים לעשות מסלול מורכב, "ממש כמו לעבור את ההימלאיה". "הם צריכים לצאת מזרם הדם, לחדור את הדופן של כלי הדם, להגיע לרקמה, ללכת בתוך הרקמה, להגיע לתאי בטא. מסלול רציני מאוד שהוא כללי לכל המחלות האלה".
האסטרטגיה שבחרו פרופ' גרוזמן וצוותו היא לא לתת לליקוציטים, תאי הדם הלבנים, לעזוב את זרם הדם. "לשים מחסום בכניסה להימלאיה", הוא מסכם. "להם יש מסלול שהם משתמשים בו כדי לעזוב את כלי הדם, ואנחנו סוגרים להם את הכניסה למסלול, סוגרים את השער על ידי מולקולות קטנות". השער הזה נשלט על ידי חלבון בשםPECAM-1 . "החלבון הזה חי בבדידות, כמו רווק מבוגר", פרופ' גרוזמן מסביר בחיוך. "הוא מסתובב בדם, נמצא בדופן של כלי הדם וגם בתאים הלבנים. לבדו".
אבל אז מגיעה הציטוקין - מולקולה שמעבירה פקודות לתאים הלבנים לעזוב את הדם ולהיכנס לרקמה, "והיא אומרת לחלבון הבודד: תשמע, אנחנו צריכים להעביר את הליקוציטים במקום מסוים מהדם לתוך הרקמה. לצורך כך, החלבון מוצא לו בן זוג, PECAM-1 נוסף, ויחד כזוג הם נקראים 'דימר'. ברגע ששניהם מתחברים הם יוצרים מפתח שפותח שער בדופנות האנדותל – זה החלק בכלי הדם שדרכו הליקוציט נכנס".
 זה בדיוק מה שאנחנו עושים - קושרים את המפתח במקום רחוק מהדלת, ומונעים ממנו לפתוח אותה. קרדיט צילום: shutterstock
זה בדיוק מה שאנחנו עושים - קושרים את המפתח במקום רחוק מהדלת, ומונעים ממנו לפתוח אותה. קרדיט צילום: shutterstock
"המולקולה שלנו נקשרת לאותו 'דימר'. כלומר, רק לצורה המופעלת שהתחברה משני החלבונים", מסביר פרופ' גרוזמן את מנגנון הפעולה של GT-73. "כשיש זוג, המולקולה שלנו נכנסת בין שני החלבונים הבודדים ונקשרת בקשר קובלנטי - קשר כימי בין שני אטומים הנוצר כתוצאה משיתוף של אלקטרונים ביניהם". התוצאה היא שהדימר הזה לא יכול עוד לעבוד. "כשהוא קשור למולקולה שלנו, הוא לא יכול לתווך את כניסת הליקוציט לרקמה. הוא מפסיק לתפקד".
האנלוגיה שפרופ' גרוזמן נותן מבהירה את העניין: "זה כאילו קשרנו לך את מפתח הבית לאוטו. אתה רוצה לפתוח את הבית, אבל המפתח קשור בשרשרת ברזל לאוטו - אז איך תפתח את הבית? זה בדיוק מה שאנחנו עושים - קושרים את המפתח במקום רחוק מהדלת, ומונעים ממנו לפתוח אותה".
פרופ' גרוזמן ממשיך לתאר בהתלהבות את החלק הגאוני בתרופה, זה שמונע את ההתקף האוטואימוני בלבד, בלי לפגוע בפעילות החיובית של התאים החיסוניים: "השערים לרקמה נפתחים רק כשיש סיגנל להתקפה אוטואימונית. כשאנחנו סוגרים את השערים האלו, השערים האחרים לא נפגעים. הליקוציטים יכולים לעבור כדי להרוג חיידקים בגוף, וירוסים ותאים סרטניים - שזה מה שהם אמורים לעשות - אבל את השערים להתקפה אוטואימונית אנחנו סגרנו. התרופה שלנו נקשרת בקשר קוולנטי - זה קשר כימי יציב, וכך אנחנו מנטרלים את המפתח הזה לזמן מאוד ארוך". החומר גם יודע להגיע למקום המדויק בחלבון ורק שם היא נקשרת, בלי לגרום לאפקטים רעילים. התוצאה מדהימה: "אם מישהו נוטל את התרופה ואין לו מחלה אוטואימונית, היא לא תעשה לו שום דבר. היא כמו מים מבחינתו".
שילוב של מזל וגאונות
השם GT-73 אינו מקרי. " GTאלו ראשי התיבות של ד"ר תמר גיתר, תלמידה מדהימה ומבריקה שלי, שסִנתזה את המולקולה הזאת להגיע לשלב כל כך מתקדם בפיתוח תרופות. היא גאונה ממש", אומר פרופ' גרוזמן בגאווה. "תמר עשתה פוסט-דוקטורט בארה"ב, חזרה לישראל ועובדת בתעשיית התרופות בארץ, והמספר 73 זה פשוט מספר החומר הסינתטי מכל הסינתזות שהיא עשתה".
 פרופ' אריה לב גרוזמן במעבדה בבר-אילן. קרדיט צילום: ארכיון המצולם
פרופ' אריה לב גרוזמן במעבדה בבר-אילן. קרדיט צילום: ארכיון המצולם
אז איך נמצאה המולקולה הספציפית הזאת? "קודם כול היה לנו מזל", אומר פרופ' גרוזמן בכנות. "אנחנו תמיד עובדים באותה שבלונה - מפתחים תרופות וירטואליות במחשב, מכירים את החלבון, יודעים לאן צריך להכניס את המפתח כדי לסגור אותו. את העבודה הזאת עשה חברנו למחלקה לכימיה, פרופ' חנוך סנדרוביץ. בסוף בחרנו 15 מולקולות, סנתזנו אותן, ובדקנו אותן בצלחות", ואז קרה הדבר המדהים: "כבר בבדיקה הראשונה של שלושה חומרים, אחד מהם הראה לנו אפקט מדהים - %100 סגירה של השערים האלו". זה היה רגע קריטי. "אמרנו: טוב, אם יש לנו כבר בצלחות חומר שעובד כל כך טוב בריכוז נמוך - נתקדם הלאה גם לחיות". והם אכן התקדמו, וראו גם יעילות וגם אי-רעילות.
ואיך היו התחושות במעבדה באותו הזמן? "הניסוי הראשון היה בארבעה מודלים: מחלת קרוהן, טרשת נפוצה, כבד שומני ודלקת במפרקים. כשראינו שבכמה מודלים החומר גורם לאפקט תרפויטי ולא רעיל - הבנו שזה משהו מדהים, ואז צעקנו 'אאוריקה'. התחושה הייתה נהדרת".
הפרויקט התבצע בשיתוף פעולה בינלאומי אמיתי. "התחלנו ככימאים, אני ותמר, והיה לנו שותף, ביולוג מגרמניה, שאמר פתאום 'אני לא רוצה לעבוד איתכם, מפסיקים את הפרויקט'. הוא לא אמר שזה קשור לישראל, אבל אנחנו הבנו".
פרופ' גרוזמן לא התייאש. "חיפשתי ומצאתי בשווייץ את פרופ' ביאט אימהוף, יו"ר הארגון האירופאי לאימונולוגיה - בן אדם ענק. הוא היה פנסיונר מאוניברסיטת ז'נבה וההתמחות שלו היא בדיוק החלבון הזה. התגובה שלו הייתה מיידית: 'בחיים לא ראיתי כזה אפקט, זה פשוט מטורף. החומר שלכם סוגר את ה-PECAM-1 והליקוציטים לא יכולים לברוח מהדם. בוא נעבוד יחד'".
בסופו של דבר השתתפו כאן ארבעה גופים קריטיים: המעבדה לכימיה רפואית, המעבדה לכימיה חישובית (שעליה כאמור היה אחראי פרופ' חנוך סנדרוביץ' מבר-אילן), המעבדה לביולוגיה של מערכת חיסונית (שווייץ), וחברה ישראלית בשם Science Action מרחובות, שערכה בדיקות ביולוגיות בחיות על חשבונה.
7 באוקטובר: כשהמדע נתקל במציאות
המסע התחיל ב-2017 באופטימיות רבה, "אבל אחר כך היו כל מיני קשיים פיננסיים. הצלחנו להקים סטארטאפ אחד, ואחר כך שני, אבל בגלל הבעיה עכשיו בהשקעות במדינת ישראל, גם מצד חברות וגם מצד משקיעים פרטיים - בגלל המלחמה ובגלל כל התנועות האנטי-ישראליות - פשוט נעצרנו".
.jpg) ד"ר תמר גיתר - מי שסנתזה את המולקולה gt-73 ולכן המולקולה נקראת על שמה. קרדיט צילום: ארכיון המצולמת.
ד"ר תמר גיתר - מי שסנתזה את המולקולה gt-73 ולכן המולקולה נקראת על שמה. קרדיט צילום: ארכיון המצולמת.
המכה הקשה ביותר הגיעה ממש אחרי 7 באוקטובר 2023. "חברה מחו"ל שחתמה איתנו הסכם לקחה ליסינג על הפטנט והייתה צריכה לתמוך בנו עד לבדיקות הקליניות, ואז הם אמרו שהם לא רוצים להשקיע בחברות ישראליות בגלל שיקולים תדמיתיים". פרופ' גרוזמן מסכם שנים של תסכול: "אם היינו מקבלים כסף לניסויים קליניים היינו כבר במקום אחר לגמרי. אנחנו לא שם. גייסנו לא מעט כסף, עשינו את כל העבודות הפרה-קליניות, אבל עכשיו אנחנו צריכים בערך 12 מיליון דולר ואנחנו לא מסוגלים לגייס את הכסף".
הסיבות מורכבות. "יש עכשיו פריצת דרך מדהימה בטיפול גנטי והתרופות מאוד מאוד יקרות. הממשלות משלמות על זה, והן משתלבות בסלי התרופות במדינות המפותחות ולכן חברות התרופות הולכות על זה חזק. השנה אושרו לשימוש עשרות תרופות גנטיות, ולכן אף אחד לא כל כך רוצה להשקיע בדבר ישן מהמאה ה-17 כמו מולקולה אורגנית קטנה", אומר פרופ' גרוזמן בתסכול.
פרופ' גרוזמן נולד ברוסיה, גדל בבית של מהנדסים, ומגיל חמש חלם להיות רופא. "כילד קטן חשבתי שאתעסק במחקר רפואי ואהיה רופא", הוא מספר. אחרי שנתיים וחצי של לימודי רפואה ברוסיה, השערים נפתחו והוא עלה לישראל ב-1991. והיה מאושר שלגלות שהתקבל ללימודי תואר ראשון במחלקה לכימיה באוניברסיטת בר-אילן. "כל החיים רציתי להמציא תרופות חדשות שירפאו אנשים", הוא מודה. אחרי שסיים דוקטורט בהצטיינות יתרה בבית הספר לרוקחות בירושלים, נסע ללימודי פוסט-דוקטורט באוניברסיטת קליפורניה בסן פרנסיסקו, שם עסק בחקר החלבון במחלה הניווניתALS . ארבע שנים לאחר מכן חזר והתקבל למשרת מרצה בכיר בבר-אילן, "ועד היום ברוך השם אני פה", הוא מחייך.
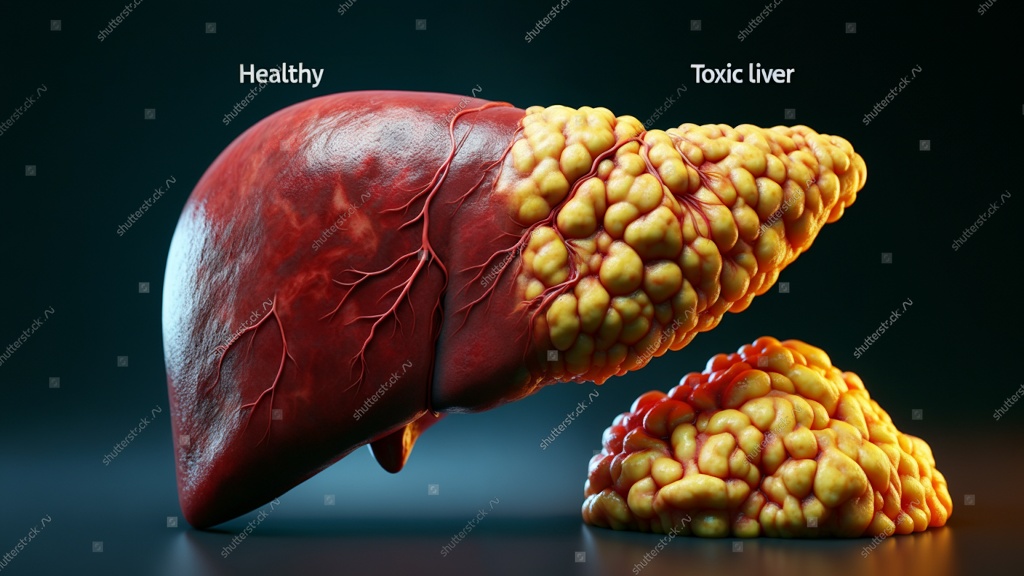 כבד בריא לעומת כבד חולה. "כשראינו שבכמה מודלים החומר גורם לאפקט תרפויטי ולא רעיל - הבנו שזה משהו מדהים". צילום: shutterstock
כבד בריא לעומת כבד חולה. "כשראינו שבכמה מודלים החומר גורם לאפקט תרפויטי ולא רעיל - הבנו שזה משהו מדהים". צילום: shutterstock
"כימיה אורגנית היא דיסציפלינה מאוד ישנה. כבר במאה ה-17 התעסקו בה", מסביר פרופ' גרוזמן, "אבל היא הבסיס להרבה מאוד דברים אחרים שמהם אפשר לקבל עכשיו פריצות דרך במדע". הבעיה, לדבריו, היא שהמדע עוסק יותר ויותר בטרנדים אופנתיים עכשוויים, ואנשים שמתעסקים במדע קלאסי הם "קצת אאוטסיידרים".
"אם אתה לא משקיע במדע בסיסי, אם אתה לא מגדל דור שיודע מה זה כימיה אורגנית, לא יודע לסנתז מולקולות, ואחר כך אתה דורש לעשות מחקרים יוקרתיים וחדשניים - זה בחיים לא יקרה. זה כמו להכין בדים בשביל בגדים אופנתיים - עוד דור אחד, עוד 20 שנה, לא יהיו סטודנטים שידעו כימיה אורגנית סינתטית - שמקבילה ליצירת בדים, אז איך יתפרו בגדים אופנתייים מרהיבים כשאין מי שיודע לייצר את הבד בשביל הבגד?"
החזון: אושר, יצירה ואהבה
למרות הקשיים, פרופ' גרוזמן וצוותו כבר בחרו את שתי המחלות שאיתן ירצו להתקדם לניסויים קליניים: כבד שומני אוטואימוני ומחלת קרוהן. "כבר קיבלנו אישור לפני המלחמה", הוא אומר. למה לא טרשת נפוצה? "כי יש תרופה טובה, וחוץ מזה קשה מאוד לעקוב אחרי הסימפטומים הנוירולוגיים. לכן, בשלב הראשון רצינו ללכת על דבר פשוט שעובד במערכת העיכול - אתה נוטל את הכדור דרך הפה והוא מגיע ישירות למערכת העיכול ופועל בה, בלי לדאוג שהחומר יתפזר למקום אחר". פרופ' גרוזמן לא מפסיק לחלום. "מבחינת כימיה תרופתית התקדמנו יפה גם בתחום של ALS וגליובלסטומה - סרטן מוח אגרסיבי".
איך ייראה העולם בעוד עשר שנים אם יפתחו עוד תרופות כאלו? "וואו, זה יהיה מדהים", מתלהב פרופ' גרוזמן. "אם אנחנו מחסלים את המחלות האוטואימוניות אנשים יחיו באושר, יהיה להם יותר זמן לדברים אחרים - ליצירה, לאהבה, לכל הדברים שאדם לא פנוי לעשות כשהוא חולה".
"כמו שפתרנו את המחלות הבקטריאליות ותוחלת החיים עלתה מ-30 עד 85, כך גם נפתור את המחלות האוטואימוניות. נקבל פן נוסף ביכולת שלנו ליהנות מהחיים האלו ולעשות בהם מה שאנחנו רוצים ולא מה שהמחלה מכריחה אותנו לעשות ולא לעשות. יהיה שיפור משמעותי גם באיכות חיים וגם באורך החיים".
תאריך עדכון אחרון : 05/01/2026