אימונותרפיה של הדור הבא – להתיר את רסן תאי ההרג הטבעיים (NK)
מערכת החיסון שלנו מצליחה, בדרך כלל, להתמודד עם איומים כמו חיידקים, וירוסים, פטריות, ואף עם תאי גוף שהתחלקו שלא לצורך כתוצאה ממוטציה ב-DNA. מדוע, אם כן, כושלת מערכת החיסון שלנו בהתמודדות עם מחלת הסרטן?
אחת הסיבות לחוסר יכולתה של מערכת החיסון להגיב באופן יעיל מול תאים סרטניים, היא שהתאים הסרטניים מצליחים ליצור סביבם תנאים המדכאים את תגובת מערכת החיסון, או להשתמש בטכניקות המאפשרות חמיקה ממערכת החיסון. כאן נכנסת לתמונה האימונותרפיה.
אימונותרפיה: פריצת דרך חשיבתית
אימונותרפיה היא גישה טיפולית המתבססת על רתימת מערכת החיסון של החולה כדי שתוכל להגיב ביעילות נגד מחלת הסרטן ומחלות אחרות. מחקרים חדשים, שמצליחים לפענח את האופן שבו תאים סרטניים מדכאים את מערכת החיסון, או חומקים ממנה, הובילו לפריצות דרך בחשיבה על פיתוח אסטרטגיות לאימונותרפיה, במטרה למצוא דרכים לחסימת היכולת של תאים הסרטניים לדכא את מערכת החיסון.
במחקר פורץ דרך שפורסם בכתב העת המדעי EMBO Molecular Medicine, ביקשו מדעני המעבדה לאימונותרפיה בראשות פרופ' מירה ברדה-סעד מהפקולטה למדעי החיים באוניברסיטת בר-אילן למצוא טיפול ממוקד בסרטן שיעצור את הגורמים לדיכוי "תאי ההרג הטבעיים" של מערכת החיסון, ויאפשר להם לפעול בעוצמה רבה יותר נגד הגידול הסרטני.
תאי ההרג הטבעיים – קו ההגנה הראשון של הגוף
מערכת החיסון היא מכלול של תהליכים ביולוגיים שמגינים על גופנו מפני מיקרו-אורגניזמים מעוררי מחלות. מערכת החיסון מורכבת משתי מערכות משנה השלובות זו בזו – מערכת החיסון המולדת, ומערכת החיסון הנרכשת.
מערכת החיסון המולדת תוקפת באופן מיידי כל תא זר שהיא מזהה, תוך הבחנה במוטיבים כלליים המזהים פתוגנים אולם לא במוטיבים ספציפיים.
מערכת החיסון הנרכשת מותאמת כדי לפעול ספציפית נגד מעוררי מחלות שפלשו לגוף, והיא גם מסוגלת לזכור ולזהות מעוררי מחלות – אך פעולתה אינה מיידית.
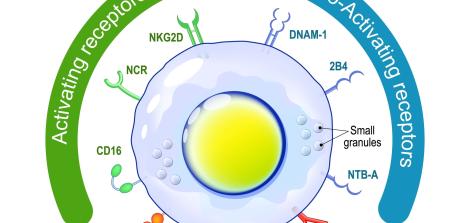
אחד מסוגי תאי הדם הלבנים השייך למערכת החיסון המולדת הוא תאי ההרג הטבעיים (NK – Natural Killer Cells). תאים אלה הם לימפוציטים הפועלים ברקמות שבגופנו ונעים בזרם הדם ההיקפי, ותפקידם לחסל פתוגנים כמו תאים סרטניים ומיקרו-אורגניזמים זרים כגון וירוסים, חיידקים וטפילים. תאי ההרג הטבעיים מהווים את קו ההגנה הראשון של הגוף מרגע החשיפה לגורם הזר ועד מיגורו או עד שמערכת החיסון הנרכשת נכנסת לפעולה.
פעילותם התקינה של תאי ה-NK תלויה באיזון בין אותות כימיים חיוביים שמפעילים אותם ובין אותות שליליים שמעכבים את פעולתם. כאשר תאי ה-NK פוגשים בתאים סרטניים, אמורים לפעול המסלולים החיוביים שמובילים להרג תאי הסרטן, ואילו כאשר הם פוגשים בתאי גוף בריאים – אמורים לפעול המסלולים השליליים המונעים פגיעה בתאים.
במקרים מסוימים, נראה כי תאי הסרטן מצליחים לשבש את פעילותם התקינה של תאי ה-NK ולגרום לעיכובם במקום לשפעולם. מחקרים קודמים חשפו כיצד תאי הסרטן עושים זאת: באמצעות הפרשת גורמים המעכבים את פעילות תאי ה-NK ושיבוש יכולתם לפעול נגד התאים הסרטניים. המולקולות שהתא הסרטני מפריש זוהו כ-Cbl ו-Shp-1, (שנהגות: "סיביל" ו"שיפ", בהתאמה). אפשר לומר כי הפעלת הסיביל והשיפ "כובלת" את ידי תאי ההרג הטבעיים ומונעת מהם לפעול במלוא עוצמתם, מה שמאפשר לתא הסרטני לשגשג.
אתגרי המחקר: איתור המנגנון עצמו, אופן מסירתו והוכחת יעילות ובטיחות
המחשבה שעמדה מאחורי המחקר היא מציאת דרך שתאפשר לתאי ההרג הטבעיים להשתחרר מה"רסן" שמחזיק אותם. במילים אחרות: פיתוח תכשיר שיהיה מסוגל לחדור לתאי הסרטן ולחסום בהם את היכולת להפעיל את מולקולות הסיביל והשיפ המעכבות את פעילות תאי ההרג הטבעיים וע"י כך שפעול ביתר שאת של תאי ההרג הטבעיים, ע"י עיכוב המעכבים.
השגת מטרה זו כרוכה במציאת מענה למספר אתגרים:
א. מציאת המנגנון לחסימת הפרשת המעכבים
המנגנון שנבחר הוא השבתה גנטית של אותם גנים בתא הסרטני שאחראים על הפרשת מולקולות השיפ והסיביל, באמצעות siRNA, "משתיק RNA". מדובר במולקולה המורכבת מרצף קצר של חומצות גרעין (RNA), האחראית על כמה תפקודים, ביניהם הפרעה לפעילות של גנים והשבתת פעולתם. תפקידן של מולקולות אלה התגלה בצמחים בשנת 1999, ומאז למדו המדענים לשלוט בהן כדי להביא להשתקה של גנים.
במחקר הנוכחי, עיצבו המדענים מולקולות siRNA שמיועדות ספציפית להשבתת הגנים האחראים על ביטוי השיפ והסיביל – אותם גורמים מעכבי תאי מערכת החיסון. בניסוי בתאים, אישרו המדענים כי מולקולות ה-siRNA אכן יעילות בהשגת מטרתן ומסוגלות לכבות את הגנים המפרישים את שיפ וסיביל.
המחקר בתאים אישר כי התכשיר אכן מסוגל לחדור לתאים ולגרום להשתקת הגנים המייצרים את מולקולות הסיביל והשיפ ביעילות גבוהה. כמו כן נבחנו רמות שונות של מינוני siRNA, על מנת לקבוע מהו המינון היעיל ביותר להשתקת הגנים, כלומר מינון שיהיה גבוה מספיק בשביל לגרום לתגובה הרצויה.
ב. "מסירת התרופה" (Drug Delivery) לתאי המטרה בלבד
כעת ביקשו המדענים לפתח טיפול שיהיה ממוקד בתאי המטרה הסרטניים בלבד – ולא יעורר תגובה של מערכת החיסון נגד הטיפול עצמו. אתגר נוסף הוא העובדה שבסרטן הדם, תאי הדם הסרטניים עשויים להיות מפוזרים ברחבי הגוף, ומשום כך קשה מאוד להתמקד בהם.
הפתרון שנבחר לשם כך היה שימוש במעטפת ננו-חלקיקים שומניים (Lipid Nanoparticles) – מנגנון חדשני המשמש למסירה של תרופות שונות ועושה שימוש בחלקיקים שומניים זעירים, בקנה מידה של מיליארדית המטר, כבסיס לנשיאת מולקולות פעילות לאיברי מטרה. על מנת שיוכלו להיצמד לתאים מסוימים ובתנאים מסוימים בלבד, אפשר לעצב את מעטפת הננו-חלקיקים כך שתיקשר רק לקולטני מטרה נבחרים בתאי המטרה.
היתרון העיקרי של השימוש במעטפת זאת לנשיאת רכיב ה-siRNA למסירה בתאי הסרטן היה שההרכב של החלקיקים מאפשר להם לחמוק ולנדוד בדם ובתאי הגוף, וכשלעצמם, הם אינם רעילים ואינם משפיעים על תאים בריאים.
במחקר הנוכחי נעשה שימוש חדשני בננו-חלקיקים שומניים בצורת כדוריות, אשר הכילו בתוכן את רכיב ה-siRNA למסירה לתאי ההרג הטבעיים. (תרשים A)
ציפוי של נוגדנים ל-NK
משנמצא המנגנון המתאים למסירת התרופה בגוף, נדרשו המדענים לעצב את חלקיקי הננו כך שידעו להתמקד בתאי ה-NK בלבד. לצורך כך, צופתה מעטפת חלקיקי הננו בנוגדנים, חלבונים בעלי מבנה ייחודי, שאפשרו להם להיצמד לקולטן ספציפי שנמצא על פני השטח של תא ה-NK. לשם המחשה, אפשר לומר שנוגדנים אלה שעל מעטפת הננו-חלקיק שימשו על תקן מפתח שמיועד לפתוח מנעול אחד בלבד – הקולטן שנמצא על תאי ה-NK, ולא יפעל על תאים אחרים בכלל.
אז, בדקו החוקרים את השפעת תכשיר זה בתאים (In Vitro), והוכיחו כי כצפוי, תכשיר זה ביצע את פעילותו על תאי ה-NK, מבלי להשפיע על תאים אחרים, וזאת בזכות ציפוי הנוגדנים המאפשר לתכשיר להיצמד לקולטן הספציפי.
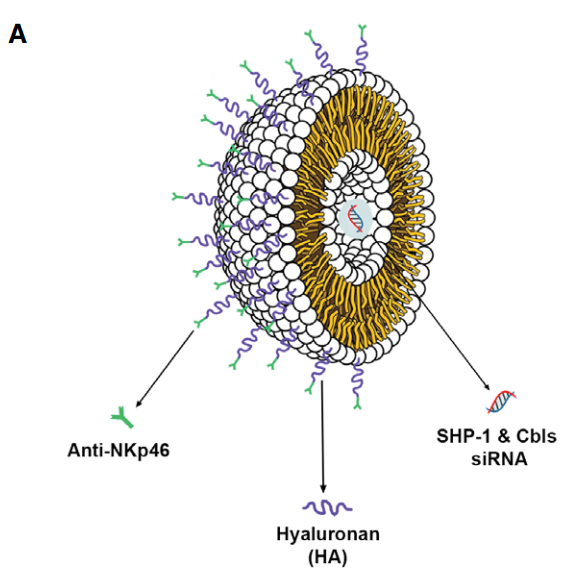 תרשים מבנה מעטפת הננו-חלקיקים השומנית,
תרשים מבנה מעטפת הננו-חלקיקים השומנית,הנוגדנים הנקשרים לקולטני תאי ה-NK, ומולקולת ה-siRNA.
ג. שמירה על פגיעה מינימלית בתאים ובאיברים בריאים
על מנת לאשר את בטיחות התכשיר ואת התאמתו העקרונית לטיפול בבני אדם, נבחן התכשיר בעכברי מעבדה. תכשיר הננו-חלקיקים הנושא siRNA פעיל הוזרק בעכברים שהושתלו בהם תאי סרטן אנושיים לימפטיים, אשר התפתחו לגידולים סרטניים, ואילו כקבוצת ביקורת, הוזרק לחלק מעכברים אלה תכשיר ננו-חלקיקים הנושא siRNA שאינו פעיל – לצורך השוואה. בסך הכול קיבלו העכברים שישה טיפולים.
במהלך הטיפול בחנו החוקרים את השפעות הטיפול על גודל הגידולים ועל קצב גדילתם, וכמו כן עקבו אחר מצבם הבריאותי של העכברים. החוקרים ציינו כי בקרב העכברים שקיבלו את הטיפול בתכשיר החדש, לא נצפו תופעות של ירידה במשקל, של עייפות, או כל עדות אחרת ללחץ או לפגיעה כתוצאה מהטיפול – וזאת לאורך תקופה משמעותית מתחילת הטיפול.
בתום המחקר, נותחו העכברים ונבחנו ריכוזים של התכשיר באיברי גוף שונים ובגידולים הסרטניים. ואכן, ריכוז התכשיר נמצא גבוה בגידולים הסרטניים, ואילו בלב, בריאות ובכליות העכברים נמצאו ריכוזים נמוכים בלבד של התכשיר – מה שמעיד על הצלחת החוקרים בעיצוב טיפול שהוא ממוקד-מטרה.
ד. הוכחת יעילות
בחלקו הסופי של המחקר, ביקשו החוקרים להעריך את יעילותו של התכשיר בהקטנת נפחם של גידולים סרטניים.
הטיפול, כך ראו החוקרים, הפחית במידה משמעותית את גודל הגידולים הסרטניים ואת קצב גדילתם, והאריך במידה משמעותית את תוחלת החיים של העכברים שטופלו בו בהשוואה לקבוצת הביקורת.
בשורה התחתונה
שילוב טכנולוגיות חדשניות ומתקדמות – כמו מנגנוני siRNA, מעטפת ננו-חלקיקים שומניים, ונוגדנים מהונדסים – הוביל לפיתוח תכשיר ממוקד-מטרה שיכול לחסום את מעכבי מערכת החיסון ובכך לרתום את תאי ה-NK רבי העוצמה למלחמה בתאים הסרטניים. בעתיד, מקווים החוקרים, יוכלו טיפולים חדשניים אלה להוות טיפול יעיל ובטוח בסוגים שונים של סרטן ובמחלות אחרות.
תאריך עדכון אחרון : 13/03/2023