לא רק קוריוז – פירוק חלבונים בלתי תלוי יוביקוויטין
מערכת יוביקוויטין-פרוטאוזום (Ubiquitin-Proteasome system, UPS) הינה הדרך העיקרית שבה התא מפרק חלבונים לא רצויים. יוביקוויטין הוא חלבון קטן המשמש בתא לסימון חלבונים שנועדו לפירוק באמצעות קומפלקס חלבוני בשם פרוטאוזום. הוספת יוביקוויטין לחלבון המיועד לפירוק מתרחשת באמצעות שלושה אנזימים – E1 המפעיל את חלבון היוביקוויטין, ו-E2 המעביר את היוביקוויטין לחלבון המיועד לפירוק (סובסטרט), אשר מזוהה באופן ספציפי על ידי האנזים E3 באמצעות זיהוי מוטיב בשם דגרון (degron).
עד כה דווח על מספר קטן של חלבונים המסוגלים לעבור פירוק פרוטאזומלי בלתי תלוי יוביקוויטין (UbInPD). עבור רבים מהחלבונים הללו, העדויות התומכות בפירוק בלתי תלוי ביוביקוויטין הושגו מניסויי מבחנה (in-vitro), ומכאן, הרלוונטיות הביולוגית של פירוק בדרך זו נותרה לא ברורה. במהלך השנים, נעשו מאמצים לאפיין את המנגנונים המולקולריים שבאמצעותם מכוונים החלבונים העוברים פירוק בלתי תלוי ביוביקוויטין לפרוטאוזום. עם זאת, בהתחשב במספר הקטן יחסית של חלבונים שזוהו, מסקנות הוסקו על בסיס כל מקרה לגופו.
בעבודה פורצת הדרך, שפורסמה בעיתון היוקרתי "Molecular Cell", קבוצת חוקרים מהארץ ומהעולם בהובלתו של ד"ר איתי קורן מהפקולטה למדעי החיים ע"ש מינה ואבררד גודמן באוניברסיטת בר-אילן הראו שמסלול פירוק פרוטאזומלי בלתי תלוי יוביקוויטין נפוץ יותר ממה שסברו עד היום והצליחו לזהות רצפים ספציפיים (מוטיבים) בחלבונים המקדמים מסלול פירוק זה.
במחקרים הקודמים שלהם, ד"ר איתי קורן ועמיתיו פיתחו והשתמשו בפלטפורמה לזיהוי דגרונים בשם GPS-peptidome כדי לחקור את הספציפיות של פירוק במערכת יוביקוויטין-פרוטאוזום. GPS-peptidome היא שיטה המודדת את יציבות החלבון בשילוב עם ייצוג סינתטי של הפפטידום האנושי (כלל פפטידים, שרשראות קצרות של חומצות אמינו, המקודדים על ידי גנום). באמצעות פלטפורמה זו, החוקרים זיהו מספר רב של דגרונים הממוקמים בקצה הקרבוקסילי של חלבונים אנושיים. מרבית הדגרונים שזוהו היו מבוקרים על ידי משפחת האנזימים E3, אך מקצתם, שבהם חומצות אמינו אלנין או ולין ממוקמות בקצה הדגרונים, לא היו מבוקרים.
כדי לאפיין את אופן הפירוק של חלבונים הנושאים מוטיבים אלו, החוקרים בחרו שלושה חלבונים מייצגים – CPS1, SREBF2 ו-OR4C13 ואיחו את הדגרונים שלהם, באורך 23 חומצות אמינו (C23mer), ובעלי המוטיב המיוחד לחלבון פלואורסצנטי ירוק (GFP). בשלב הבא, תאים המבטאים את חלבוני ה-GFP המאוחים (GFP-C23mer) טופלו או ב-MLN7243, המעכב את אנזימי ה-E1, ובכך מבטל הוספת יוביקוויטין, או במעכב פרוטאוזום bortezomib, ועקבו אחר יציבות חלבוני ה-GFP המאוחים. היציבות של החלבונים המאוחים הללו עלתה בנוכחות מעכב פרוטאוזום, אך נותרה ללא שינוי או ירדה בעקבות טיפול במעכב E1. תוצאות דומות התקבלו גם כאשר ל-GFP אוחה קצה קרבוקסילי של חלבון הידוע כעובר פירוק בלתי תלוי ביוביקוויטין, בעוד GFP שהיה מאוחה לקצה קרבוקסילי של חלבון העובר פירוק תלוי יוביקוויטין התייצב בנוכחות שני המעכבים.
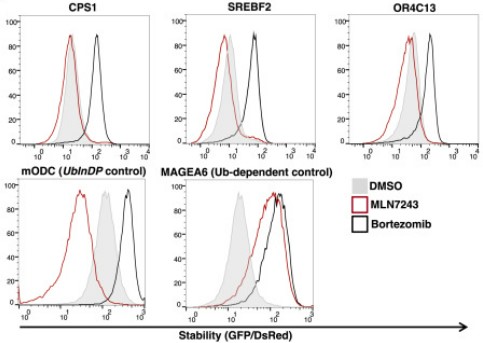 באיור – תאים המבטאים חלבון GFP מאוחה ל-23 חומצות אמינו אחרונות של החלבונים CPS1, SREBF2 או OR4C13 טופלו ב-MLN7243, המעכב את אנזימי ה-E1, או במעכב פרוטאוזום bortezomib, או בטיפול ביקורת (DMSO). כביקורת, לחלבון GFP אוחה הקצה הקרבוקסילי של החלבון mODC הידוע כעובר פירוק פרוטאזומלי בלתי תלוי יוביקוויטין או חלבון MAGEA6 הידוע כעובר פירוק תלוי יוביקוויטין. יחס GFP/dsRed מייצג את היציבות של חלבוני GFP המאוחים בנוכחות המעכב המצוין – ככל שנקודת השיא של העקומה ממוקמת ימינה יותר, כך החלבון יציב יותר.
באיור – תאים המבטאים חלבון GFP מאוחה ל-23 חומצות אמינו אחרונות של החלבונים CPS1, SREBF2 או OR4C13 טופלו ב-MLN7243, המעכב את אנזימי ה-E1, או במעכב פרוטאוזום bortezomib, או בטיפול ביקורת (DMSO). כביקורת, לחלבון GFP אוחה הקצה הקרבוקסילי של החלבון mODC הידוע כעובר פירוק פרוטאזומלי בלתי תלוי יוביקוויטין או חלבון MAGEA6 הידוע כעובר פירוק תלוי יוביקוויטין. יחס GFP/dsRed מייצג את היציבות של חלבוני GFP המאוחים בנוכחות המעכב המצוין – ככל שנקודת השיא של העקומה ממוקמת ימינה יותר, כך החלבון יציב יותר.
כדי לחפש באופן שיטתי אחר דגרונים נוספים המקדמים פירוק פרוטאזומלי בלתי תלוי יוביקוויטין, החוקרים יישמו את השיטה שפיתחו על תאים שטופלו במעכב פרוטאוזום, מעכב E1 או שלא טופלו כלל, וזיהו 1,829 דגרונים לא תלויי יוביקוויטין ו-2,121 תלויי יוביקוויטין. החוקרים אימתו את התוצאות על ידי בחינת יציבות של 13 דגרונים, שזוהו כבלתי תלויים ביוביקוויטין, בנוכחות מעכבים ומצאו שכולם התייצבו בתאים שטופלו במעכב פרוטאוזום אך התפרקו בתאים שטופלו במעכב E1. תוצאה זו מרמזת על כך שבעת עיכוב E1 יכולתו של הפרוטאוזום לפרק חלבונים ממסלול בלתי תלוי יוביקוויטין עולה.
ניתוח רצף של C23mer שפירוקם לא תלוי יוביקוויטין גילה העשרה של חומצות אמינו אלנין, ציסטאין וואלין בקצה הקיצוני שלהם. כדי לאמת באופן ניסויי את חשיבות המוטיבים הללו בתיווך פירוק פרוטאזומלי בלתי תלוי יוביקוויטין, החוקרים עשו מוטציות של החסרה או החלפה של החומצות האמינו אלנין, ציסטאין וואלין הללו. המוטציות נעשו בכ-100 C23mer-ים המפורקים במסלול פירוק פרוטאזומלי בלתי תלוי יוביקוויטין. לאחר המוטגנזה, החוקרים ראו שאכן אותן חומצות אמינו מעורבות בפירוק הפפטידים – מוטציה או מחיקות שלהן הגבירו את יציבות הפפטידים בנוכחות מעכבים. מעניין שהזזת המיקום של המוטיבים על ידי הוספת חומצות אמינו נוספות אחריהם הובילה לייצוב פפטיד, מה שמעיד על חשיבות היכולת של המוטיב להיחשף בקצה הקרבוקסילי בכדי לעבור פירוק פרוטאזומלי בלתי תלוי יוביקוויטין.
בניסויי מבחנה, גם פרוטאזום 20S וגם 26S הוכחו כמתווכים פירוק פרוטאזומלי בלתי תלוי יוביקוויטין. על מנת להבין איזה מהם מקדם את הפירוק בתאים חיים (in-vivo), החוקרים עיכבו PSMD1, תת-יחידת של פרוטאוזום 26S הנדרשת לפעילות הפרוטאוזום 26S אך לא לפעילות הפרוטאוזום 20S. בתאים ללא PSMD1, הסובסטרטים של מסלול פירוק פרוטאזומלי בלתי תלוי יוביקוויטין (איחויים של GFP-C23mer) התייצבו באופן משמעותי, מה שמעיד על כך שבתאים חיים פירוק פרוטאזומלי בלתי תלוי יוביקוויטין מתרחש בפרוטאוזום של 26S ולא 20S.
עד לשלב זה, חוקרים סרקו וחקרו סובסטרטים פפטידיים (C23mer) ואת איחוי ה-GFP שלהם. כדי להבין את המשמעות הביולוגית והמנגנון המולקולרי של פירוק פרוטאזומלי בלתי תלוי יוביקוויטין, החוקרים היו צריכים לזהות סובסטרטים שהם חלבונים שלמים. לשם כך, הם סרקו ספרייה של כ-15,000 קונסטרקטים המקודדים לחלבונים אנושיים בתאים שטופלו במעכבי פרוטאוזום או בתאים שטופלו במעכבי E1. באמצעות גישה זו זוהו 69 חלבונים כסובסטרטים פוטנציאליים של מסלול פירוק פרוטאזומלי בלתי תלוי יוביקוויטין, שכמה מהם כבר היו ידועים כעוברים פירוק במסלול זה. זיהוי מספר קטן יחסית של סובסטרטים שהם חלבונים שלמים בהשוואה לפפטידים מצביע על כך שבמקרה של חלבונים שלמים רק תת-קבוצה ספציפית של חלבונים מפורקת באופן בלתי תלוי יוביקוויטין.
בשלב הבא, כמה מהחלבונים שזוהו עברו ולידציה כחלבון עצמאי או איחוי ל-GFP בתאים שטופלו במעכב פרוטאוזום או במעכב E1. חוקרים ראו שכל החלבונים שנבדקו התייצבו בתאים המטופלים במעכב פרוטאוזום, מה שמצביע על כך שפירוק שלהם הוא תלוי פרוטאוזום. לאחר טיפול במעכב E1 רמתם של חלק מהחלבונים נשארה ללא שינויי או ירדה, כמצופה מסובסטרטים של מסלול פירוק פרוטאזומלי בלתי תלוי יוביקוויטין. הממצא מרמז על כך שגם חלבונים שלמים ולא רק פפטידים מסוגלים להתפרק במסלול פירוק בלתי תלוי ביוביקוויטין.
כדי לבחון אם הקצה הקרבוקסילי הוא אכן חשוב בפירוק פרוטאזומלי בלתי תלוי יוביקוויטין גם במקרה של החלבונים השלמים שזוהו כסובסטרטים של מסלול פירוק זה, החוקרים מחקו או הוסיפו חומצות אמינו נוספות לקצה הקרבוקסילי של החלבונים הללו ובחנו את ההשפעה על היציבות. החלבונים המוטנטיים התייצבו גם לאחר טיפול במעכב פרוטאוזום וגם לאחר טיפול במעכב E1, מה שמצביע על כך שאפשר לפרק את החלבונים הללו באופן תלוי או בלתי תלוי יוביקוויטין, ומכאן, כאשר מסלול פירוק אחד מוחלש, החלבונים מכוונים למסלול הפירוק השני.
לבסוף, החוקרים רצו להבין את המנגנון שבו מכוונים הסובסטרטים של פירוק בלתי תלוי יוביקוויטין לפרוטאוזום. חוקרים שיערו שחלבונים דמויי יוביקוויטין (Ubiquitin-like - UBL), המגשרים בין סובסטרטים לפרוטאוזום על ידי חיבור לקולטני יוביקוויטין בפרוטאזום, עשויים להיות מעורבים גם בהכוונה של סובסטרטים לפירוק בלתי תלוי יוביקוויטין. על ידי יצירת מוטציות חסר של חלבוני UBL שונים, חוקרים גילו שרק לאחר החסרה משולשת של חלבוני משפחת יוביקווילין (Ubiquilin - UBQLN1, UBQLN2 ו-UBQLN4) בשילוב עם עיכוב E1, חל ייצוב של סובסטרטים חלבוניים של מסלול פירוק פרוטאזומלי בלתי תלוי יוביקוויטין. נוסף על כך, החוקרים הדגימו אינטראקציה פיזית בין UBQLN1 לחלבון שמפורק במסלול בלתי תלוי יוביקוויטין ומיפו את האזור ב-UBQLN1 המעורב בהכוונה למסלול זה.
לסיכום, המחקר מייצג גישה שיטתית בחקר פירוק פרוטאזומלי בלתי תלוי יוביקוויטין ומראה שפירוק במסלול זה נפוץ יותר ממה שהעריכו עד כה. דרושים עוד מחקרים נוספים על מנת לפענח מנגנון חשוב ומורכב זה.
עבודה זו פורסמה ב"ScienceDirect".
תאריך עדכון אחרון : 12/11/2024