מיפוי אתרי עריכת הרנ"א בגנום האנושי פותח דלת לטיפולי העתיד
עריכת רנ"א היא תחום מחקר חדש ומבטיח, השואף לרתום לטובת הרפואה המותאמת אישית את אחד המנגנונים העתיקים והנפוצים ביותר במערכת התורשה.
בתא, משמשת עריכת רנ"א חלק ממערכת החיסון התוך-תאית ונוסף על כך היא מאפשרת ייצור חלבונים שלא הותוו בקוד הגנטי המקורי, ובכך מאפשרת להרחיב את עושר החלבונים שאפשר להפיק מהקוד הגנטי שבדנ"א.
בשנים הקרובות מקווים מדענים מתחומי הביו-טכנולוגיה והביולוגיה החישובית לרתום את יכולת הגוף לערוך רנ"א כדי לתקן פגמים גנטיים ולרפא מחלות קשות שהיום הן חשוכות מרפא, לרבות סרטן. כדי להבין את מנגנוני עריכת הרנ"א, יש למפות תחילה את האזורים בגנום שבהם מתרחשות עריכות של רנ"א.
בגוף האדם, החלבון העיקרי המבצע עריכה גנטית הוא אנזים המכונה ADAR – אדנוזין דאמינז. מחקר פורץ דרך של המעבדה לביולוגיה חישובית באוניברסיטת בר-אילן, בהובלת פרופ' ארז לבנון, יחד עם פרופ' אליהו איזנברג מהפקולטה למדעים מדויקים באוניברסיטת תל אביב, ביקש למפות את האתרים בגנום האנושי שבהם מתבצעת עריכה גנטית באמצעות ADAR.
רקע: על דנ"א, רנ"א וחלבונים
כדי להבין את המיפוי שביקשו החוקרים לבצע, יש להבין תחילה כיצד מתרחש תהליך ייצור החלבונים, שהם אבני הבניין של הגוף. נקודת ההתחלה היא המידע התורשתי המְקֻדָּד באורגניזם.
כלל המידע התורשתי באורגניזם מכונה גנום, והוא מְקֻדָּד במולקולת הדנ"א. מולקולת הדנ"א בנויה כשרשרת של בסיסים חנקניים המכונים נוקלאוטידים. כל מולקולת דנ"א מורכבת מארבע תת-יחידות של נוקלאוטידים, המהוות את ארבעת הבסיסים של הקוד הגנטי: אדנין (A), גואנין (G), תימין (T) וציטוזין (C), המחוברים בזוגות לאורך גדיל דנ"א כפול. הגנום האנושי מורכב מרצף מדויק של יותר מ-3 מיליארד זוגות. רובו של רצף הגנום האנושי זהה, ורק פחות מ-1% ממנו ייחודי לכל אדם ומבטא את השונות הגנטית בין בני האנוש.
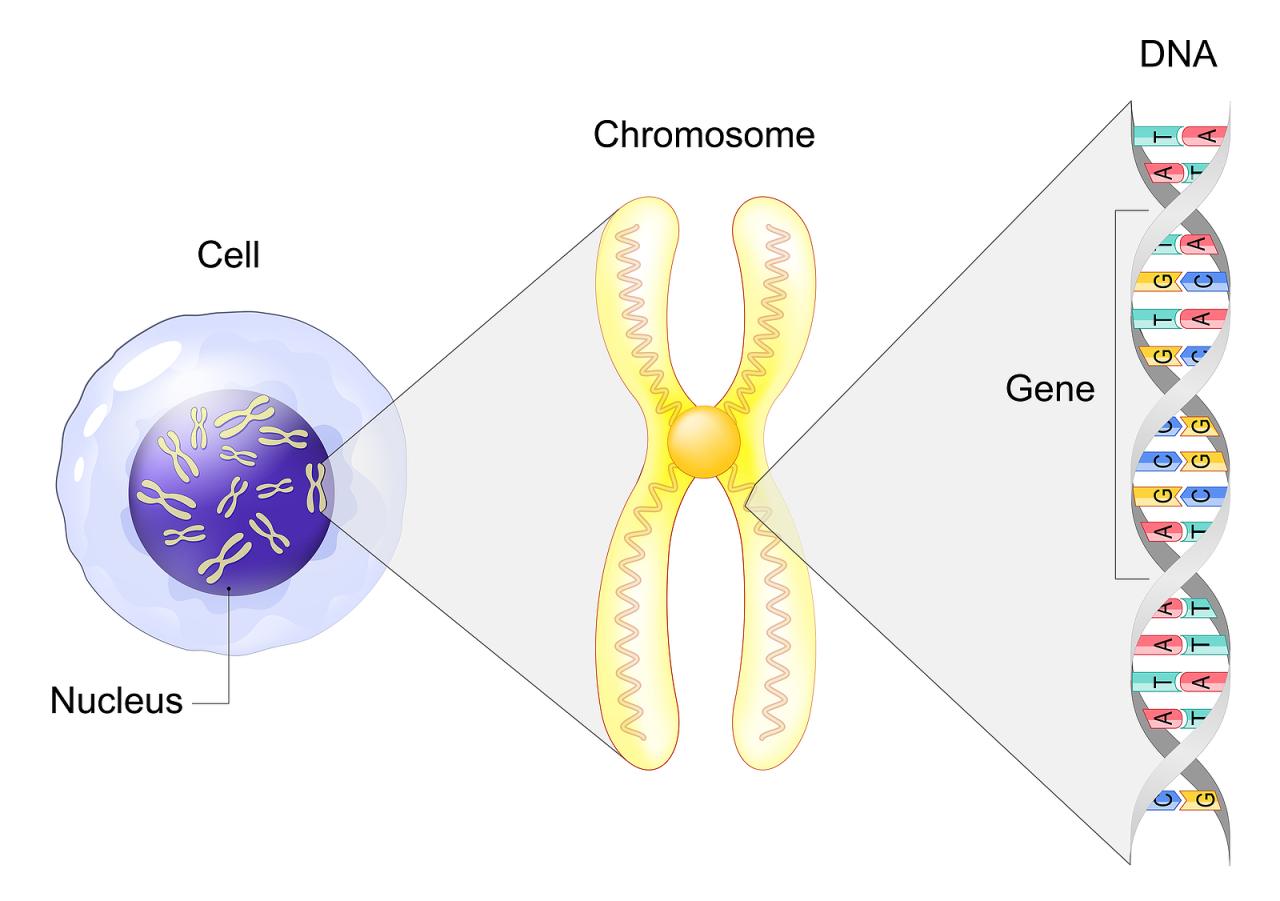 רצפי הנוקלאוטידים יוצרים את גדילי הדנ"א
רצפי הנוקלאוטידים יוצרים את גדילי הדנ"א
על בסיס המידע המוצפן בדנ"א, מתרחש בתאים תהליך ייצור חלבונים בשני שלבים עיקריים:
א. שעתוק המידע הגנטי בדנ"א למולקולות רנ"א – מולקולות דומות אך קטנות יותר ובעלות גדיל אחד שמורכב מאותו רצף של חומצות גרעין ששועתק מקוד הדנ"א. גם מולקולת הרנ"א מורכבת מארבעה סוגי בסיסים: C, A ו-G שהוזכרו קודם לכן, ואורציל (U) במקום התימין – T.
ב. תרגום קוד הרנ"א לייצור חלבונים – אבני הבניין של הגוף. תהליך זה מתבצע על ידי הריבוזומים - מבנים מיוחדים של רנ"א וחלבון, מעין מכונות מיקרוסקופיות, אשר על בסיס המידע ששועתק לרצפי רנ"א המכונים 'רנ"א שליח', מרכיבים שרשראות של חומצות אמינו לכדי חלבונים שונים.
בין שני שלבים אלה, פועלים בתאים מנגנוני בקרה המשפיעים על חומצות הגרעין ועל החלבונים. אחד מאותם מנגנוני בקרה הוא מנגנון טבעי של עריכת הרנ"א.
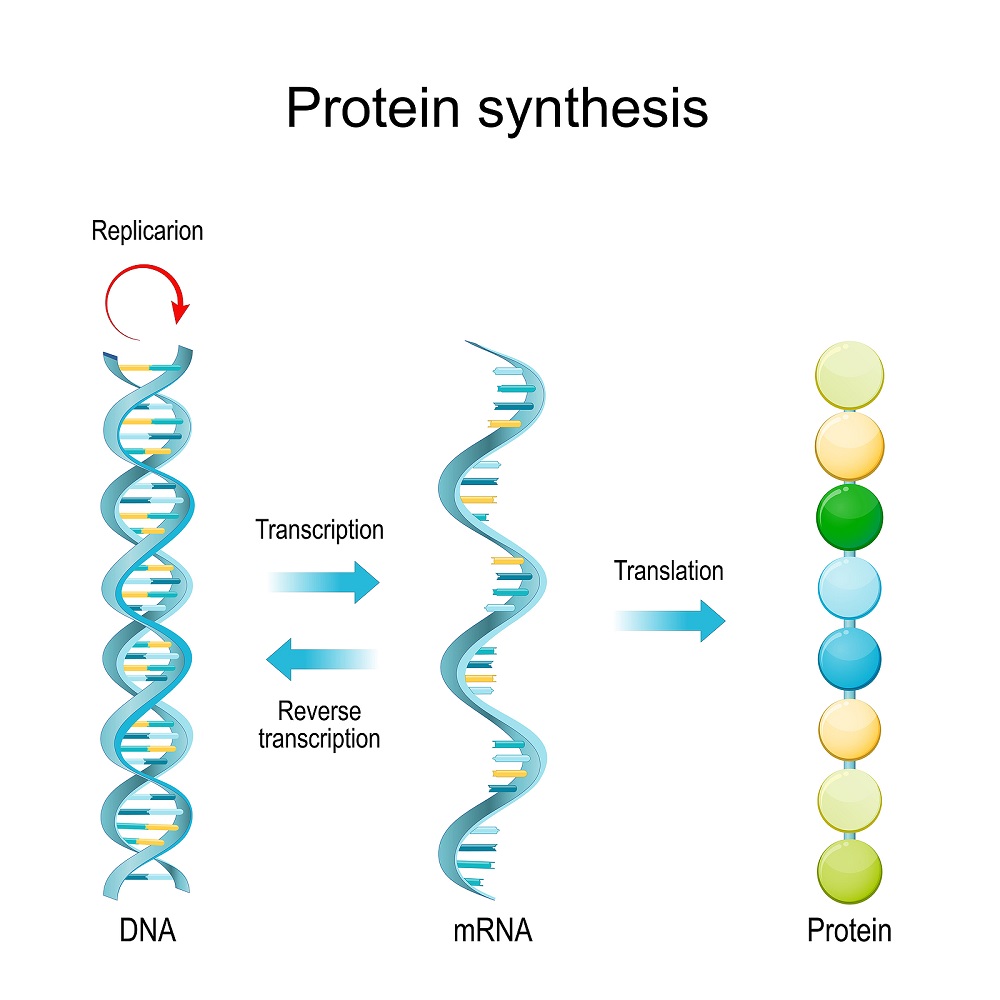 מדנ"א דרך רנ"א לחלבון: שלבי השעתוק והתרגום העיקריים
מדנ"א דרך רנ"א לחלבון: שלבי השעתוק והתרגום העיקריים
עריכת רנ"א: מנגנון בקרה טבעי בגוף
מנגנון העריכה הטבעית של רנ"א התגלה לראשונה בצמחים בשנות ה-80 של המאה הקודמת אך הובחן מאז כמעט בכל היצורים הרב-תאיים. לעריכת הרנ"א תפקיד במנגנונים ביולוגיים רבים, ממערכת החיסון המולדת ועד להתפתחות העצבים.
בתהליך עריכת הרנ"א, חל שינוי ברצף הנוקלאוטידים במולקולת הרנ"א, לאחר שזו שועתקה מהדנ"א אך טרם תורגמה לחלבון. כאשר פעולת העריכה הזאת מתרחשת בגנים המקודדים לחלבון, היא גורמת לתא לייצר חלבונים נוספים מעבר לאלו שהתוו ברצף הדנ"א שהם בעלי תפקוד שונה, שיכולים לשמש בנסיבות שונות. לדוגמה, החלפה של הנוקלאוטיד C ב-U בתאי המעי מובילה לייצור החלבון Apo B-48 המסייע בספיגת חומרים מזינים מתוך המעיים לגוף. במילים אחרות, מנגנון עריכת הרנ"א מעשיר את המורכבות הביולוגית היכולה להיווצר מהרצף הגנומי.
גם באזורים בגנום שאינם מקודדים לחלבון, פעולת עריכת הרנ"א היא חיונית כחלק ממערכת החיסון התוך-תאית, זאת על ידי עריכת אזורי רנ"א דו-גדיליים וסימונם באופן שיגרום לכך שלא יזוהו כווירוסים על ידי מערכת החיסון.
בגוף האדם, פעולת עריכת הרנ"א מתרחשת בכל סוגי התאים, בכל איברי הגוף, בהיקפים עצומים של מיליוני מקרי עריכות ברגע נתון, ויש לה תפקיד מכריע במערכת הגנטית עצמה, במערכת החיסון המולדת, כמו גם בהתבטאות של חלבונים שונים. מחקרים שפורסמו בעשור האחרון מתחילים לחשוף את הקשרים שבין תפקוד מערכת עריכת הרנ"א לבין מצבי בריאות וחולי. כך, למשל, נמצא קשר בין תפקוד לקוי של מנגנון עריכת הרנ"א ובין מספר מחלות נוירולוגיות. כמו כן נמצא קשר בין תפקוד לקוי של עריכת רנ"א ובין דיכאון אובדני, שסעת, אפילפסיה, טרשת אמיוטרופית צידית (ALS) ואף במגוון מחלות סרטן.
הכירו את גיבור המחקר – האנזים ADAR
העריכה הגנטית באורגניזמים שונים מתרחשת באמצעות אנזימים. באדם, אנזים העריכה הגנטית הראשי הוא אנזים ממשפחת החלבונים ADAR (Adenosine Deaminase acting on RNA), אדנוזין דהמיניאז, הנמצאים בתאיהם של כמעט כל היצורים מרובי התאים.
אנזים זה עורך את מולקולת הרנ"א על ידי החלפת הבסיס אדנוזין (A) ב-אינוזין (ו). אינוזין הוא בסיס שאינו אחד מחמשת הבסיסים המרכיבים את הדנ"א ואת הרנ"א שהוזכרו לעיל (A), (C), (G), (T), ו-(U), אך בפועל מערכת תרגום החלבונים בתא מזהה אותו כגואנזין (G) ומייצרת את החלבונים בהתאם, כאילו בקוד המקורי היה גואנין.
היות ואנזים האדנוזין דהמיניאז יודע לעשות שינויים בקוד הרנ"א באופן טבעי, הוא עשוי להיות ה"גיבור" העתידי של ריפוי באמצעות עריכת רנ"א, על ידי ביצוע תיקונים של פגמים גנטיים וריפוי מחלות שונות, לרבות סרטן.
האתגרים במיפוי אתרי עריכת רנ"א
אף כי קיומם של אתרי עריכת רנ"א בגוף וחשיבותם הולכים ונחשפים, עד כה נכשלו הניסיונות לייצר מפה מקיפה של אתרים אלה. הסיבה לכך היא שמיפוי אתרי עריכת הרנ"א כרוך באתגרים לא פשוטים.
הדרך למפות ולזהות אתרים של עריכה גנטית היא באמצעות השוואת רצפי הרנ"א אל מול הגנום לצורך איתור אי התאמות – למשל מציאת המקומות שבהם התחלף הנוקליאוטיד A בנוקליאוטיד G. אולם, לא כל אי התאמה ברצפים מעידה על עריכה גנטית. למעשה, בכל דגימה ממוצעת של הרצפים אפשר למצוא כמות גדולה של אי-התאמות בין רצף הדנ"א ובין רצפי הרנ"א הנובעות מסיבות שאינן קשורות למנגנון העריכה הגנטית, אלא בעיקר לשונות באוכלוסייה או פשוט לטעויות טכניות.
מכאן, התעורר צורך בגיבוש מערכת חישובית שתשלב את הצעדים הרבים למיפוי רצפי הרנ"א לגנום, ותצליח להפריד באופן יעיל בין אי-התאמות שנובעות מעריכה גנטית ובין אי-התאמות שנובעות מסיבות אחרות.
משימה זו כוללת כמה אתגרים. ראשית צריכים המדענים להבדיל בין עריכה גנטית ובין וריאציות של רצף הדנ"א המכונות SNP (רב-צורניות של נוקלאוטיד בודד), שעשויות להיות שונות בין אדם לאדם ואינן מעידות על עריכה גנטית. שנית, תהליך הריצוף הגנטי עצמו, הכולל המרה של מולקולות הרנ"א למולקולות דנ"א משלים (cDNA), יכול ליצור מוטציות שיתפרשו בטעות כאתרי עריכת רנ"א. שלישית, על מנת להשוות בין רצפי הרנ"א ובין קוד הדנ"א, יש למפות תחילה את הרנ"א, ומכאן שטעויות במיפוי הרנ"א לגנום עשויות גם הן להוביל למציאת "אי-התאמות" שכלל אינן קיימות. נוסף על כך, ידוע כי חלק גדול ממקרי העריכה מתרחש באזורים בדנ"א שאינם מקודדים לחלבון ויש בהם חזרתיות גבוהה, כלומר אתרים שקשה למפותם.
במחקר הנוכחי, שפורסם בכתב-העת המדעי היוקרתי "Nature Communications", ביקשו החוקרים לחשוף את אחד המנגנונים החשובים והנפוצים ביותר בתהליך השעתוק הגנטי של מרבית היצורים החיים – עריכת רנ"א שבה הבסיס A בבסיס I באמצעות אדנוזין דהמיניאז (ADAR).
כדי לעשות זאת, פיתחו החוקרים גישה חדשה לזיהוי של אותם אתרים שבהם מתרחשת עריכת הרנ"א, המיועדת להתגברות על האתגרים שצוינו לעיל, וחשפו מפה מלאה של 1,517 אתרי עריכה.
שיטות מחקר
המחקר החישובי התבסס על אנליזות של כמויות גדולות של דגימות ורצפים גנטיים של בני אדם ושל בעלי חיים אחרים.
מקור המידע העיקרי שבו השתמשו החוקרים היה נתוני ריצוף רנ"א אנושי שנלקחו מדגימות ריצוף רנ"א של פרויקט GTEx, מאגר נתונים מחקרי בינלאומי לחקר התבטאות הגנים ברקמות הגוף השונות. בסך הכול נחקרו 9,125 דגימות רצפי רנ"א של 47 רקמות שונות שהתקבלו מ-548 תורמים.
נתוני ריצוף רנ"א של יונקים אחרים נלקחו ממגוון מקורות, ובסך הכול נחקרו 5,673 דגימות רצפי רנ"א מ-21 מיני יונקים שאינם אנושיים.
אף כי קובצי שיוך רצפי הרנ"א לרצף הגנטי ה"נכון" שלהם היו זמינים לחוקרים, הם העדיפו להתעלם מהמפות הקודמות שעשויות היו להסוות את מיקומם של אתרי העריכה, והשתמשו בנתונים בצורתם הגולמית, כדי למפות לפיהם את אתרי העריכה הנסתרים.
מיפוי דיגיטלי של המידע הביולוגי
כעת המירו החוקרים את רצפי הדגימות לפורמט המכונה BAM, פורמט בינארי לאחסון מידע גנטי, ומיפו אותם בהתאם לרצף גנום ששימש מודל להשוואה.
לאחר מכן ניתחו החוקרים את כל נקודות אי-ההתאמה שנצפו בין קוד הדנ"א ובין רצפי הרנ"א על פי מגוון פרמטרים שאפשרו להם לבודד את האתרים שבהם מתרחשת פעילות עריכה משמעותית, ולהתעלם ממקרי דמויי עריכה כתוצאה משונות גנטית או אלו שנגרמו מסיבות טכניות.
בקצרה, החוקרים התמקדו באזורים של הרצף הגנטי שמקודדים לחלבון, והתעלמו מעריכה גנטית שמתרחשת באזורים בדנ"א שאינם מקודדים לחלבון. כמו כן התעלמו החוקרים מאזורים שבהם הובחן מספר רב של סוגי החלפות בסיסים, מתוך הנחה שאזורים אלה נובעים משיוך טכני שגוי של הקוד הגנטי לרצף רנ"א.
החוקרים סיננו אי-התאמות שהתגלו בקרב מספר קטן של תורמים, בהנחה שאלו מייצגות החלפות נקודתיות המבטאות הבדלים אינדיווידואליים בין התורמים. כמו כן, החוקרים סיננו אזורים שבהם נצפתה העריכה בתדירות של פחות מ-1%.
באופן זה, לאחר סינון התוצאות, הצליחו החוקרים לקבל תמונה מדויקת של 1,517 אתרים בקוד הגנטי המקודד לחלבון שבהם מתרחשת העריכה הגנטית מסוג A ל-I. במקביל, הראו החוקרים כי עריכות אלה מתרחשות במקומות מסוימים וקבועים בגן.
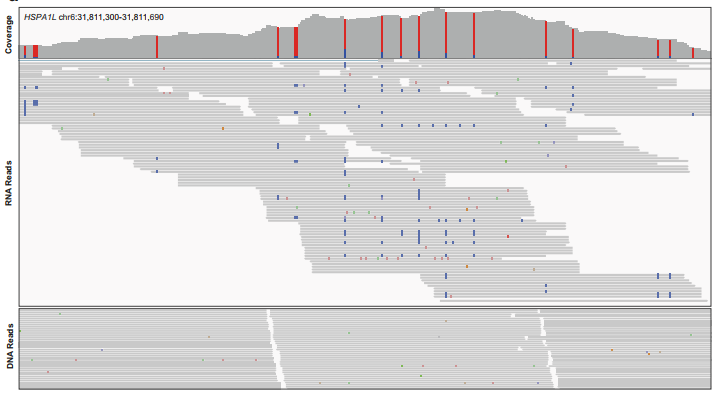 מקבץ של אתרי עריכה בגן HSPA1L 19. אתרי עריכת רנ"א התגלו במקטע זה שבו 391 זוגות בסיסים.
מקבץ של אתרי עריכה בגן HSPA1L 19. אתרי עריכת רנ"א התגלו במקטע זה שבו 391 זוגות בסיסים.באמצע – אי-התאמות בין הדנ"א לרנ"א (באדום – החלפת A, בכחול החלפת הבסיס G).
למטה – השוואה בין רצף הדנ"א לרצפי הרנ"א משלושה תורמים שונים, אתרי העריכה נמצאו במיקומים תואמים.
תוצאות: מנגנון מיפוי חדש
החוקרים מציעים גישה חדשה ומנגנון מפורט לזיהוי אתרי עריכת הרנ"א באזורי הקידוד של הדנ"א. על ידי התמקדות בעריכה גנטית המתבצעת באזורי הדנ"א המקודדים לחלבון, וסינון מיליוני אי-התאמות שאינן קשורות לאתרים אלו, הצליחו החוקרים לאתר 1,517 אתרי עריכת A ל-I באדם, כמעט כולם לא היו ידועים עד כה.
על מנת להפגין את רמת הדיוק של הכלי החישובי שפיתחו, מיפו החוקרים את אתרי עריכת הגנים בקרב 21 יונקים אחרים, והצליחו לזהות את אתרי העריכה הגנטית שהיו ידועים עד כה בעכבר.
בשורה התחתונה
מיפוי אתרי עריכת הרנ"א של A ל-I באמצעות ADAR פותח דלת למחקרים נוספים שיחשפו את הפוטנציאל המלא של עריכת הרנ"א, כפי שהיא מתבטאת ברקמות, בתהליכים ביולוגיים ובמצבי מחלה. תוך שימוש במפות אלו, יוכלו החוקרים לפתח מגוון רחב של אסטרטגיות הנדסת רנ"א לטיפול הן במחלות גנטיות והן במחלות נרכשות כגון סרטן.
פוטנציאל לריפוי מחלות גנטיות נדירות
ההתקדמות הטכנולוגית בתחום הריצוף הגנטי ובתחום המחשוב סייעה למדענים בתחום הביולוגיה החישובית לחשוף את תפקידיו של מנגנון זה, והם מקווים כי בשנים הקרובות יוכלו להשתמש בו לתיקון פגמים גנטיים הגורמים למחלות קשות.
בדומה לטכנולוגיות מתקדמות אחרות בתחום ההנדסה הגנטית כגון קריספר, גישה זאת של עריכת רנ"א נושאת פוטנציאל לתיקון פגמים גנטיים ידועים הגורמים למחלות תורשתיות חשוכות מרפא. אך בניגוד לעריכת דנ"א, שגורמת לשינויים גנטיים בלתי הפיכים ולעיתים אף בלתי רצויים, מולקולות הרנ"א מתקיימות למשך זמן קצר בלבד, ולפיכך השינוי בהן הוא זמני ותופעות הלוואי בנות חלוף.
בהשוואה לטכנולוגיות קיימות אחרות לעריכה גנטית, ובראשן טכנולוגיית הקריספר הפועלת על הדנ"א ונושאת שינויים ארוכי טווח, עריכת הרנ"א באמצעות ADAR מציעה יעילות זהה ופועלת לטווח קצר בלבד, כך שבמידה שמתגלות תופעות לוואי בלתי רצויות אפשר להפסיק את הטיפול.
תאריך עדכון אחרון : 15/01/2023