טיפול במחלות נדירות: ד"ר עינת זלצקבר מפצחת את הפרוקסיזום
מחלות גנטיות נדירות מהוות אתגר אדיר לחוקרים. אלה מחלות ששכיחותן נמוכה מאוד, מה שמעמיד מכשול גדול בפני הניסיון לחקור אותן ולמצוא להן תרופות. לא רק שקשה ולעיתים אף בלתי אפשרי לבצע ניסויים קליניים כאשר יש כל כך מעט חולים, אלא שגם לחברות התרופות אין, מטבע הדברים, אינטרס מסחרי לממן את המחקרים.
אלא שהמחלות הנדירות למעשה – במצטבר – לא כל כך נדירות. ההערכה היא כי היום חיים בישראל חצי מיליון חולים במחלות גנטיות נדירות, שהם 6-8% מהאוכלוסייה – כלומר, יותר מהחולים בסרטן, פרקינסון ואלצהיימר יחד. בעולם מגיע מספר החולים במחלות גנטיות נדירות ליותר מ-300 מיליון. אבל מכיוון שמדובר בכ-7,000 מחלות שונות לפחות – לא כולל מחלות נוספות שטרם אובחנו – הרבה מהן לא נחקרות כמעט בכלל.

ד"ר עינת זלצקבר. צילום: דרור מוטולה
הפרוקסיזום: כוכב הסרט "השמן של לורנצו"
המחלות הגנטיות הנדירות משתרעות על ספקטרום רחב מאוד: חלקן מחלות מאוד קשות, והילדים שסובלים מהן נפטרים תוך ימים או חודשים, וחלקן פוגעות בהדרגה ביכולות מסוימות כמו בכושר הראייה, השמיעה או התנועה.
אחת המפורסמות שבהן היא המחלה הנקראת X-ALD, שכיכבה בסרט "השמן של לורנצו" בשנת 1992, שהתבסס על סיפורו האמיתי של לורנצו אודונה, שנולד כילד רגיל ובסביבות גיל חמש התחיל לסבול מהתקפי זעם שהביאו בסופו של דבר לאבחון של מחלה תורשתית קשה שמקורה בבעיה במנגנון פירוק השומנים בתא. מכיוון שזו היתה מחלה נדירה, חברות התרופות לא התעניינו במימון מחקר והוריו ישבו בעצמם בספריות עד שמצאו לבסוף פתרון בדמות שמן שיעזור לעכב את הנזק שנגרם לבנם.
המחלה בסרט,X-ALD, היא אחת המחלות הגנטיות שנגרמות על ידי שיבוש באברון של התא הקרוי פרוקסיזום, שבו החלה להתעניין בשנים האחרונות ד"ר עינת זלצקבר ממרכז דנגור לרפואה מותאמת אישית, והפקולטה למדעי החיים באוניברסיטת בר-אילן.
עינת, תוכלי להסביר מה זה בדיוק פרוקסיזום?
"התאים שלנו בנויים כמו עיר. הם מורכבים מיחידות שכל אחת מהן מומחית בתחום שלה, אבל כולן חייבות לעבוד יחד. היחידה המרכזית היא הגרעין, שהיא מעין עירייה, ובה יושב החומר התורשתי; באברון אחר, שנקרא מיטוכונדריה, יושב מרכז האנרגיה של התא; הליזוזום הוא מרכז מִחזור הפסולת של התא, כי התא הוא מערכת מאוד אקולוגית, והפסולת שלו משמשת לצרכים אחרים. הפרוקסיזום הוא אברון קטנטן, בקוטר של כ-150 ננו מטר (ננומטר שווה למיליארדית המטר), שמתרחשות בו הרבה פעולות, לרבות פירוק חומרים רעילים כמו רדיקלים חופשיים. כשהפרוקסיזום נפגע – נגרמת מחלה".
איך הגעת לחקור דווקא את הפרוקסיזום?
"במשך עשר שנים חקרתי במכון ויצמן תאים של שמרים, ולא תאים אנושיים, אבל תא של שמרים מאוד דומה לתא של אדם. כמו שאנחנו יודעים מטיפול בבצקים, כשנותנים לשמרים סוכר וטמפרטורה נעימה – הם גדלים מאוד. נוסף על כך, קל לעשות עליהם שינויים גנטיים. מי שהציעה לי לחקור את הפרוקסיזומים היא פרופ' מאיה שולדינר. באותו זמן בכלל לא ידעתי על קיומם, ונראָה לי מוזר שהיה ידוע על קיומו של האברון הזה 60 שנה, ובכל זאת לא ידענו עליו כמעט כלום".
וזה אומר שנשאר הרבה מה לגלות עליו.
"כן. פיתחנו כלים לחקור את הפרוקסיזום תוך שימוש בשמרים. לא ידענו מה כל התפקידים של הפרוקסיזום ולא ידענו הרבה על החלבונים שנמצאים בו, אבל גילינו 40 חלבונים שלא ידעו שהם נמצאים שם, וחקרנו את תפקידם של חלק מהם".
רפואה מותאמת אישית: להשתמש בתאים של החולה עצמו
במעבדה של ד"ר זלצקבר בבר-אילן, שנפתחה באוקטובר 2023, עובדים עוד ארבעה חוקרים, והיא צפויה לגדול בקרוב. "עובדים במעבדה נשים וגברים, חרדים וחילונים – יש פה מגוון, וזה מאוד חשוב לי. אני חושבת שהמגוון תורם לחשיבה היצירתית". הם מגדלים במעבדה תאים של בני אדם, המגיעים מביופסיה של העור הלקוחה מהחולה עצמו, ועורכים ניסויים על התאים של החולה שעבורו מיועדת התרופה. "לא מדובר במודל או בחיה דומה, אלא ממש באדם עצמו, שלו מיועדת התרופה, מה שמאפשר לנו להיות הרבה יותר ממוקדים".
מהו הטיפול שמוצע כיום לחולים במחלות שנגרמות על ידי פגם בפרוקסיזום?
"לרוב המחלות שנגרמות על ידי פגם בפרוקסיזום אין כמעט שום טיפול שנבדק מחקרית. לחלק מהחולים ב-ALD, למשל, מציעים השתלת מח עצם. לפעמים, במקרים של מחלות פרוקסיזומליות מציעים שינוי תזונתי כי הפרוקסיזומים מפרקים חומצות שומן מסוימות, כך שהחלפת הדיאטה לתפריט דל בשומנים או במוצרי חלב יכול להקטין את העומס על הפרוקסיזום. לכן, חשוב להשקיע מאמצים בניסיון לעזור לחולים האלה".
איך ניגשים לפרויקט פיתוח תרופות למחלות נדירות כל כך?
"בדרך כלל לא ריאלי לצאת לפיתוח ממש מאפס. לכן, אחת האסטרטגיות המרכזיות נקראת 'Drug Repurposing' – עוברים על שורה של תרופות שכבר אושרו לשימוש על ידי ה-FDA למחלות אחרות, ובודקים איך הן משפיעות על תפקוד התאים של החולה המסוים. אנחנו משתמשים במערכות ייחודיות של רובוטים המחוברים למיקרוסקופים, שמאפשרים לנו לסרוק הרבה תרופות בתוך זמן קצר".
אתם משקיעים מאמצים עצומים בטיפול שיעזור למספר מאוד מצומצם של חולים.
"שואלים אותי הרבה פעמים 'למה לעבוד על מחלות נדירות? אין מספיק מקרים של סרטן?' אבל אני קודם כול מאמינה שזאת חובתנו המוסרית לעזור לכל אדם. במשנה כתוב: 'כל המציל נפש אחת –כאילו הציל עולם ומלואו'. ויש גם עניין נוסף, כי לפעמים כשאנחנו מבינים מנגנונים של פגמים בתא במקרה של מחלה נדירה, אנחנו מגלים גילויים שמאפשרים לנו לטפל במחלות אחרות, הרבה יותר שכיחות. למשל, תרופות נפוצות מאוד להורדת כולסטרול, שרבים משתמשים בהן כיום, פותחו במקור לטיפול במחלה נדירה שגרמה לרמות גבוהות של כולסטרול שהצטבר במפרקים. כאשר מצאו את הטיפול למחלה הנדירה, אפשר היה להשתמש בידע כדי לפתח תרופה גם למחלה השכיחה יותר של עודף כולסטרול".
כלומר, הבנת הפרוקסיזום רלוונטית לא רק למחלות הנדירות?
"נכון. המחקר בפרוקסיזום יכול לשפוך אור על מחלות שכיחות בהרבה כמו סרטן והשמנת יתר – שכן הפרוקסיזום אחראי על פירוק שומנים בתא".
"מחלות שקופות"
בשנים האחרונות מקדמת ד"ר זלצקבר חיבורים בין רופאים, חוקרים, תעשיית הביו-טק ועמותות חולים במחלות גנטיות נדירות. היא חברה בקבוצת 8400 נדירות, חבורת עילית של נשות ואנשי המחקר התעשייה והרפואה בישראל, שאליה היא הוזמנה כדי לקדם יחד את נושא המחלות הנדירות, ולאחרונה הקימה יחד עם פרופ' מאיה שולדינר ופרופ' איילת ארז ובשיתוף אוניברסיטת בר-אילן ומכון ויצמן למדע את האתר למחלות גנטיות נדירות בישראל, שמטרתו להנגיש מידע על המחלות הנדירות.
"הצורך בהקמת האתר עלה כי על הרבה מהמחלות האלה אין מידע אמין ועדכני בעברית או בערבית. באוניברסיטת בר-אילן יש ריכוז של חוקרים וחוקרות שחוקרים מחלות גנטיות נדירות, ואנחנו מארגנים מפגשים בין חוקרים ורופאים כדי לשפר את שיתוף המידע בנושא. האינטראקציה בין הגורמים הנוגעים בדבר מאוד חיונית: הרופא מומחה בצד הקליני, אני מומחית בצד המדעי והמשפחות מכירות את המקרה יותר טוב מכולם – אבל אף אחד מאיתנו לא יודע הכול, ולכן כולנו חייבים לעבוד יחד".
מי שיעבוד לבד לא יצליח
אפשר לומר שאת הקריירה שלה בתחום הגנטיקה התחילה ד"ר זלצקבר בגיל 15, כאשר לכיתתה נכנסה מורה מחליפה למדעים, ולימדה גנטיקה. "מה שהיא לימדה העיף לי את מוח. נפעמתי. בסוף השיעור אמרתי לעצמי – זה מה שאני רוצה לעשות כשאני אהיה גדולה". אחרי תואר ראשון באוניברסיטת תל אביב היא השלימה דוקטורט במכון ויצמן, וכיום מעבדתה נמצאת במרכז דנגור לרפואה מותאמת אישית באוניברסיטת בר-אילן.
למה בחרת דווקא בבר-אילן?
"בר-אילן היא אוניברסיטה מאוד מגוונת חברתית, יש פה סטודנטים מכל המגזרים בישראל, נוסף לסטודנטים מחו"ל, ומגוון הוא כוח כי הוא מפגיש בין אנשים עם הסתכלות אחרת על הדברים. גם האווירה בין המדענים והמדעניות יוצאת דופן כאן – יש הרבה שיתוף פעולה ופרגון הדדי. הרגשתי את זה במיוחד בתור מדענית חדשה, כשקולגות ממש עזרו לי עם רעיונות ופידבקים".
איזה טיפ יש לך לתת לחוקרת או חוקר בתחילת דרכם?
"אני חושבת שסטודנטים שממשיכים לתארים מתקדמים במדעי החיים מגיעים בדרך כלל מסקרנות ותשוקה לגלות דברים חדשים. לאורך רוב המסלול המחקרי הניסויים שלהם לא מצליחים, כי כך זה עובד במדע. זה קשה לסטודנטים, שהם בדרך כלל מי שהיו כל חייהם המצטיינים, ופתאום הם צריכים להתמודד עם ה'כישלונות', לחשוב למה הדברים לא עבדו ולהמשיך הלאה. תכונה מרכזית של מי שמצליחים בתחום הזה למרות הקשיים היא היכולת לשתף פעולה. מי שינסה לעבוד לבד, פשוט לא יצליח".
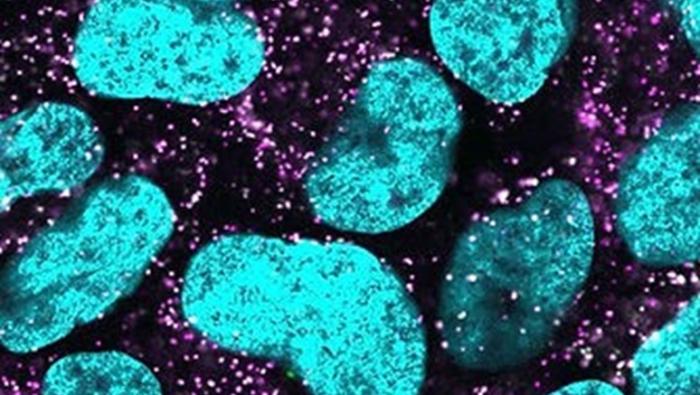
תמונה ראשית: פרוקסיזום (בסגול) בתאי אדם, מתחת למיקרוסקופ. קרדיט: תמר כהן.
תאריך עדכון אחרון : 12/11/2024